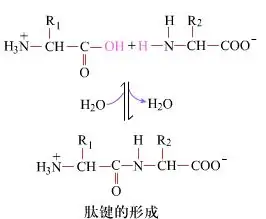
ຢູ່ເທິງຫນ້າດິນ, ການສ້າງຕັ້ງພັນທະບັດ peptide, dipeptide ໃຫ້ຜົນຜະລິດ, ແມ່ນຂະບວນການທາງເຄມີທີ່ງ່າຍດາຍ. ນີ້ຫມາຍຄວາມວ່າສອງສ່ວນປະກອບອາຊິດ amino ແມ່ນເຊື່ອມໂຍງໂດຍຄວາມຜູກພັນທີ່ peptide, ເປັນພັນທະບັດ amide, ໃນຂະນະທີ່ຂາດນ້ໍາ.
ການສ້າງຕັ້ງພັນທະບັດ Peptide ແມ່ນການກະຕຸ້ນຂອງອາຊິດ amino ພາຍໃຕ້ເງື່ອນໄຂການຕິກິລິຍາທີ່ອ່ອນໂຍນ. (ກ) meto carboxyl, ອາຊິດ amino ທີ່ສອງ (b) nucleophilic moiety carboxyl metiet ຫຼັງຈາກນັ້ນປະກອບເປັນ dipeptide (A-B). "ຖ້າຫາກວ່າສ່ວນປະກອບຂອງ carboxyl (ກ) ບໍ່ໄດ້ຮັບການປົກປ້ອງ, ການສ້າງຕັ້ງພັນທະບັດ peptide ບໍ່ສາມາດຄວບຄຸມໄດ້." ໂດຍຜະລິດຕະພັນເຊັ່ນ: peptides ເສັ້ນແລະຮອບວຽນອາດຈະປະສົມກັບທາດປະສົມເປົ້າຫມາຍ A-B. ສະນັ້ນ, ທຸກກຸ່ມທີ່ເປັນປະໂຫຍດທີ່ບໍ່ມີສ່ວນຮ່ວມໃນ peptide ພັນທະບັດຕ້ອງໄດ້ຮັບການປົກປ້ອງໃນລັກສະນະທີ່ປ່ຽນແປງຊົ່ວຄາວໃນການສັງເຄາະ peptide.
ສະນັ້ນ, ການສັງເຄາະ peptide - ການສ້າງຕັ້ງຂອງແຕ່ລະພັນທະບັດ peptide - ກ່ຽວຂ້ອງກັບສາມບາດກ້າວຂອງການລວບລວມ.
ຂັ້ນຕອນທໍາອິດແມ່ນການກະກຽມອາຊິດ amino ບາງຊະນິດທີ່ຕ້ອງການການປ້ອງກັນ, ແລະໂຄງສ້າງ zwitterionic ຂອງອາຊິດ amino ບໍ່ມີອີກແລ້ວ.
ຂັ້ນຕອນທີສອງແມ່ນປະຕິກິລິຍາສອງຂັ້ນໃນການສ້າງຕັ້ງພັນທະບັດ peptide, ໃນກຸ່ມອາຊິດ amino ຂອງ netide ທີ່ຖືກປົກປ້ອງເປັນກາງແລະຫຼັງຈາກນັ້ນຄວາມຜູກພັນຂອງ peptide ແມ່ນສ້າງຕັ້ງຂຶ້ນ. ປະຕິກິລິຍາທີ່ມີຄວາມເພິ່ງພໍໃຈນີ້ສາມາດເກີດຂື້ນໄດ້ວ່າເປັນປະຕິກິລິຍາຫນຶ່ງບາດກ້າວຫຼືເປັນສອງປະຕິກິລິຍາທີ່ເປັນບວກ.
ຂັ້ນຕອນທີສາມແມ່ນການກໍາຈັດທີ່ເລືອກຫຼືການໂຍກຍ້າຍທີ່ສົມບູນຂອງພື້ນຖານປ້ອງກັນ. ເຖິງແມ່ນວ່າການໂຍກຍ້າຍທັງຫມົດພຽງແຕ່ສາມາດເກີດຂື້ນໄດ້ຫຼັງຈາກທີ່ຕ່ອງໂສ້ທັງຫມົດໄດ້ຖືກປະກອບ, ການເລືອກກຸ່ມປ້ອງກັນກໍ່ຕ້ອງການໃນການສືບຕໍ່ setthesis.
ເນື່ອງຈາກວ່າ 10 ອາຊິດ amino (Ser, THR, Tyr, ASP, PLU, SEC ແລະ CYS) ມີການປ້ອງກັນທີ່ມີລະບົບຕ່ອງໂສ້, ເຮັດໃຫ້ການປ້ອງກັນເລືອກທີ່ສັບສົນຫຼາຍ. ຖານຂໍ້ປ້ອງກັນຊົ່ວຄາວແລະເຄິ່ງຖາວອນຕ້ອງໄດ້ຮັບການຈໍາແນກໄດ້ເນື່ອງຈາກຄວາມຕ້ອງການທີ່ແຕກຕ່າງກັນສໍາລັບການເລືອກ. ກຸ່ມປົກປ້ອງຊົ່ວຄາວແມ່ນໃຊ້ໃນຂັ້ນຕອນຕໍ່ໄປເພື່ອສະທ້ອນໃຫ້ເຫັນການປ້ອງກັນຊົ່ວຄາວຂອງອາຊິດ amino ຫຼືກຸ່ມທີ່ເປັນປະໂຫຍດ. ກຸ່ມປ້ອງກັນເຄິ່ງຖາວອນໄດ້ຖືກລຶບອອກໂດຍບໍ່ຕ້ອງແຊກແຊງພັນທະບັດ peptide peptide ຫຼືອາຊິດອາຊິດອາຊິດ amino, ບາງຄັ້ງໃນໄລຍະການສັງເຄາະ.
"ໂດຍຫລັກການແລ້ວ, ການສ້າງຕັ້ງພັນທະບັດ carboxyl (ປະຕິກິລິຍາຄູ່ຜົວເມຍ) ຄວນຈະໄວ, ໂດຍບໍ່ມີການປ່ຽນແປງ, ໂດຍບໍ່ຄວນໃຊ້ກັບຜົນຜະລິດສູງ." ແຕ່ໂຊກບໍ່ດີ, ບໍ່ມີວິທີການຂອງສານເຄມີທີ່ຕອບສະຫນອງຄວາມຕ້ອງການເຫຼົ່ານີ້, ແລະມີຫນ້ອຍທີ່ເຫມາະສົມກັບການປະຕິບັດການປະຕິບັດຕົວຈິງ.
ໃນລະຫວ່າງການສັງເຄາະ peptide, ກຸ່ມທີ່ກ່ຽວຂ້ອງແມ່ນມັກຈະເຊື່ອມໂຍງກັບສູນປື້ມຄູ່ມື, glycine ເປັນຂໍ້ຍົກເວັ້ນພຽງແຕ່, ແລະມີຄວາມສ່ຽງທີ່ຈະຫມູນວຽນ.
ຂັ້ນຕອນສຸດທ້າຍໃນວົງຈອນ sonthesis peptide ແມ່ນການໂຍກຍ້າຍຂອງກຸ່ມປ້ອງກັນທັງຫມົດ. ການໂຍກຍ້າຍຂອງກຸ່ມປ້ອງກັນແມ່ນສໍາຄັນສໍາລັບການຂະຫຍາຍລະບົບຕ່ອງໂສ້ຂອງ peptide ນອກເຫນືອຈາກຄວາມຕ້ອງການສໍາລັບການກໍາຈັດການປ້ອງກັນຢ່າງສົມບູນໃນການປ້ອງກັນ dipeptide. ຍຸດທະສາດສັງເຄາະຄວນໄດ້ຮັບການວາງແຜນຢ່າງລະມັດລະວັງ. ອີງຕາມທາງເລືອກຍຸດທະສາດ, N ສາມາດເລືອກເອົາກຸ່ມປົກປ້ອງαinoຫຼື carboxyl ຫຼື carboxyl. ຄໍາວ່າ "ຍຸດທະສາດ" ຫມາຍເຖິງລໍາດັບຂອງປະຕິກິລິຍາຂົ້ນຂອງອາຊິດ amino ຂອງອາຊິດສ່ວນບຸກຄົນ. ໂດຍທົ່ວໄປ, ມັນມີຄວາມແຕກຕ່າງກັນລະຫວ່າງການສັງເຄາະເທື່ອລະກ້າວແລະການອະນຸລັກສະເປັກ. Peptide Synthesis (ເຊິ່ງເອີ້ນກັນວ່າ "ການສັງເຄາະແບບທໍາມະດາ") ເກີດຂື້ນໃນການແກ້ໄຂ. ໃນກໍລະນີຫຼາຍທີ່ສຸດ, ຄ່ອຍໆຍືດຍາວຂອງລະບົບຕ່ອງໂສ້ peptide ສາມາດຖືກສັງເຄາະພຽງແຕ່ໂດຍໃຊ້ລະບົບຕ່ອງໂສ້ peptide ເພື່ອ sonthesized ຊິ້ນທີ່ສັ້ນກວ່າ. ເພື່ອສັງເຄາະ peptides ທີ່ຍາວກວ່າ, ໂມເລກຸນເປົ້າຫມາຍຕ້ອງໄດ້ຮັບການແບ່ງສ່ວນເຂົ້າໃນຊິ້ນສ່ວນທີ່ເຫມາະສົມແລະກໍານົດວ່າພວກມັນສາມາດຫຼຸດຜ່ອນລະດັບຄວາມແຕກຕ່າງທີ່ C T Terminus. ຫຼັງຈາກຊິ້ນສ່ວນຂອງແຕ່ລະບຸກຄົນແມ່ນຄ່ອຍໆປະກອບ, ການປະສົມເປົ້າຫມາຍຈະໄດ້ຮັບການເຂົ້າຮ່ວມ. ກົນລະຍຸດຂອງການສັງເຄາະ peptide ປະກອບມີສ່ວນປະກອບຂອງຊິ້ນສ່ວນປ້ອງກັນທີ່ດີທີ່ສຸດແລະເຫມາະສົມທີ່ສຸດປະກອບມີການຄັດເລືອກການປະສົມປະສານທີ່ເຫມາະສົມທີ່ສຸດແລະວິທີການທີ່ດີທີ່ສຸດຂອງການແບ່ງປັນຊິ້ນສ່ວນ.
ເວລາໄປສະນີ: 2025-07-02